
class 10th bharti bhawan अम्ल भस्म लवण | bihar board 10th exam 2022
class 10th bharti bhawan अम्ल भस्म लवण सभी विडियो आप हमारे YOUTUBE CHANNEL VIDYANJALI POINT पर Free me मे देख सकते है सारे best video की playlist बना दिया गया है | bihar board 10th exam 2022
सोडियम क्लोराइड (साधारण नमक, NaCl) :–

सोडियम हाइड्रॉक्साइड तथा हाइड्रोक्लोरिक अम्ल की अभिक्रिम से सोडियम क्लोराइड प्राप्त होता है।
NaOH + HCl → NaCl + H2O
भारत 95% सोडियम क्लोराइड (साधारण नमक) समुद्री जल के वाष्पीकरण द्वारा प्राप्त किया जाता है।
सेंधा एवं काला नमक (rock salt) :-
काला सेंधा नमक (rock salt) को जमीन खोदकर खदानों | (mines) से प्राप्त किया जाता है। इस नमक में अशुद्धि के रूप में लाल चिकनी मिट्टी के कण (marl) मिले होते हैं जिसके कारण नमक का रंग भूरा हो जाता है।
आयोडीनयुक्त नमक (Iodised salt) :- 
साधारण नमक में की थोड़ी मात्रा KIO3, या KI मिलाकर नमक आयोडीनयुक्त नमक बनाया जाता है।
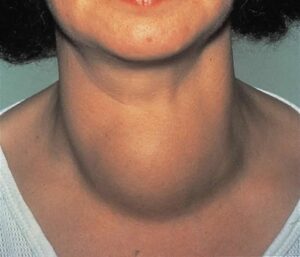
घेघा रोग (goitre) हमारे आहार (भोजन) में आयोडीन की कमी से होती है।
सोडियम क्लोराइड (साधारण नमक, NaCl) के उपयोग :-
1. मानव आहार (भोजन) का आवश्यक अंग,
2. आचार के परिरक्षण में,
3. साबुन बनाने में
4. उद्योगों में इसका उपयोग
5. क्लोरीन
6. सोडियम काबनिट (Na 2Co3),
7. सोडियम बाइकार्बनिट (NaHCO3)
8. सोडियम हाइड्रॉक्साइड (NaOH) आदि बनाने
सोडियम हाइड्रॉक्साइड बनाने की विधि-
सोडियम हाइड्रॉक्साइड को क्लोर-ऐल्कली विधि द्वारा बनाया जाता है। इस विधि में सोडियम क्लोराइड के संतृप्त जलीय विलयन का विद्युत-अपघटन किया जाता है। सोडियम क्लोराइड के जलीय विलयन में Na+ तथा CI- आयन विद्यमान होते हैं। विद्यत-अपघटन से Cl-आयन ऑक्सीकृत होकर ऐनोड पर CI2, गैस देता है तथा Na’+ कैथोड पर Na धातु में परिणत हो जाता है। सोडियम धातु जल से अभिक्रिया कर NaOH बनाता है।
सोडियम हाइड्रॉक्साइड के उपयोग-
(i) सावुन तथा अपमार्जक(detergent) बनाने में
(ii) कागज बनाने में
(iii) प्रयोगशाला में अभिकर्मक (reagent) के रूप में
हाइड्रोजन गैस के उपयोग-
1. वनस्पति तेल का हाइड्रोजनीकरण कर उन्हें वनस्पति घी में परिणत करने में
2. हैबर विधि द्वारा अमोनिया बनाने में
क्लोरीन गैस के उपयोग–
(i) कपड़ों एवं कागज को विरंजित करने में
(ii) कीटो को नष्ट करने के कारण पेयजल को शुद्ध करने में –
(iii) विरंजक चूर्ण (bleaching powder) बनाने में
सोडियम बाइकार्बोनेट (NaHCO3,) या खाने का सोडा
सोडियम बाइकार्बोनेट (NaHCO3,) को खानेवाला सोडा भी कहते हैं। इसे प्रायः अमोनिया-सोडा विधि या साल्वे विधि द्वारा तैयार किया जाता है।
अमोनिया-सोडा विधि या साल्वे विधि
सिद्धांत :- अमोनिया गैस से संतृप्त सोडियम क्लोराइड के संतृप्त जलीय विलयन (ब्राइन) में कार्बन डाइऑक्साइड गैस प्रवाहित करने के फलस्वरूप सोडियम बाइकार्बोनेट प्राप्त होता है।
NaCl (सोडियम क्लोराइड) + (जल) H2O + (कार्बन डाइऑक्साइड0 CO2 + अमोनिया ( NH3) — NH4Cl (अमोनियम क्लोराइड) + NaHCO3 (सोडियम बाइकार्बोनेट,)
सोडियम बाइकार्बोनेट गुण
1. सोडियम बाइकार्बोनेट NaHCO3 का जलीय विलयन क्षारीय होता है तथा इस विलयन का pH मान 7 से अधिक होता है
2. NaHCO3, अम्लों को उदासीन करता है तथा अभिक्रिया के फलस्वरूप Co2, गैस निकलती है।
3. NaHCO3, को गर्म करने पर यह Na2CO3, H2O तथा CO2 में अपघटित हो जाता है।
सोडियम बाइकार्बोनेट के उपयोग
1. बेकिंग पाउडर बनाने में
2. पावरोटी अथवा केक (cake) को मुलायम व स्पंजी (spongy) बनाने में
3. पेट की अम्लीयता को कम करने की औषधि (ऐंटासिड) के रूप में
4. सोडियम बाइकानिट का उपयोग अग्निशामक यंत्रों (fire extinguisher) में भी किया जाता है।
अग्निशामक यंत्र में NaHCO3, तथा H2SO4 रहते हैं।
4. रसोईघर में, खाने के सोडा का उपयोग खस्ता व्यंजन बनाने में कभी-कभी इसका इस्तेमाल खाना जल्द पकाने के लिए भी किया जाता है
धोने का सोडा (washing soda) या सोडियम कार्बोनेट
धोने का सोडा (washing soda) या सोडियम कार्बोनेट सामान्यतह अमोनिया-सोडा विधि या साल्वे विधि से तैयार किया जाता है।
अमोनिया-सोडा विधि या साल्वे विधि
सिद्धांत- अमोनिया गैस से संतृप्त सोडियम क्लोराइड के संतृप्त जलीय विलयन (ब्राइन) में कार्बन डाइऑक्साइड गैस प्रवाहित करने पर सोडियम बाइकार्बोनेट प्राप्त होता है। |
NaCl (सोडियम क्लोराइड) + (जल) H2O + (कार्बन डाइऑक्साइड0 CO2 + अमोनिया ( NH3) — NH4Cl (अमोनियम क्लोराइड) + NaHCO3 (सोडियम बाइकार्बोनेट,)
सोडियम बाइकार्बोनेट NaHCO3 को गर्म करके सोडियम कार्बोनेट Na2CO3 प्राप्त किया जाता है।
2 NaHCO3—- – Na2CO3 + CO2 + H2O
सोडियम कार्बोनट के रवाकरण से धोने का सोडा | (Na2CO3·10H2O) प्राप्त होता है।
धोने का सोडा (washing soda) या सोडियम कार्बोनेट गुण-
1. Na2CO3, का जलीय विलयन क्षारीय होता है।
2. Na2CO3, अम्लों को उदासीन बनाता है तथा अभिक्रिया के फलस्वरूप Co, गैस निकलती है। | Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
3. सोडियम कार्बोनेट (Na2CO3·10H2) को तीव्रता से गर्म करने पर अनार्द्र Na2CO3, बनता है।
Na2CO3·10H2→ Na2CO3+ 10H2O
सोडियम कार्बोनेट के विलयन में CO2 गैस प्रवाहित | करने पर सोडियम बाइकार्बनिट बनता है।
Na2CO3 + H2O + CO2 → 2NaHCO3
उत्फुल्लन (Efflorescence) —
Na2CO3·10H2O हवा में खुला छोड़ने पर रवाकरण के जल को त्याग सोडियम कार्बोनेट मोनोहाइड्रेट का चूर्ण बनना उत्फुल्लन कहलाता है।
धोने का सोडा के उपयोग-
1. कपड़ा आदि धोने में
2.प्रयोगशाला में अभिकर्मक के रूप
3.काँच, कागज, साबुन आदि के उत्पादन में
4.जल का स्थायी खारापन दूर करने में
विरंजक चूर्ण (bleaching powder) Ca(OCI)Cl
शुष्क बुझे हुए चूने [Ca(OH)2] को 40 °C तक तप्त कर उसके ऊपर क्लोरीन गैस प्रवाहित करने पर विरंजक चूर्ण (bleaching powder) प्राप्त होता है।
Ca(OH2 + Cl2 → Ca(OCI)Cl + H2O
विरंजक चूर्ण गुण-यह सफेद चूर्ण है जिससे क्लोरीन की गंध निकलती है।
1. कार्बन डाइऑक्साइड का प्रभाव-ब्लीचिंग पाउडर अत्यंत अस्थायी यौगिक है तथा वायुमंडल से CO2 एवं आर्द्रता ग्रहण कर क्लोरीन गैस देता है।
Ca(OCl)Cl + CO2 + CaCO3, + Cl2
2. जल का प्रभाव-विलयन में यह अपघटित होकर कैल्सियम क्लोराइड तथा कैल्सियम हाइपोक्लोराइट देता है।
3.अम्ल का प्रभाव- यह तनु HCI के साथ अभिाक्रया कर क्लोरीन देता है।
कैल्सियम ऑक्सी क्लोराइड Ca(OCI)Cl + हाइड्रो क्लोरिक अम्ल 2HCI → कैल्सियम क्लोराइडCaCl2 + जल H2O + क्लोरीन Cl2
विरंजक चूर्ण (bleaching powder) Ca(OCI)Cl के उपयोग
1. कीटाणुनाशक के रूप में
2. कागज एवं कपड़ों के विरंजन में
3. क्लोरीन, क्लोरोफॉर्म आदि बनाने में
class 10th bharti bhawan अम्ल भस्म लवण सभी विडियो आप हमारे YOUTUBE CHANNEL VIDYANJALI POINT पर Free me मे देख सकते है सारे best video की playlist बना दिया गया है | bihar board 10th exam 2022
प्लास्टर ऑफ पेरिस (CasO4)2 H2O या CaSO4, 1/2 H2o
जिप्सम को 120 °C तक सावधानीपूर्वक गर्म करने के फलस्वरूप प्लास्टर ऑफ पेरिस (CasO4)2 H2O या CaSO4, 1/2 H2o बनता है।
2(Caso4 2H2O) → (Caso4),2H2O + 3H2O
प्लास्टर ऑफ पेरिस प्लास्टर ऑफ पेरिस में जल मिलाने के फलस्वरूप मिश्रण तप्त होकर जिप्सम (Caso42H2O) में परिणत हो जाता है। इस प्रक्रिया में यह जमकर ठोस बन जाता है।
(CasO4)2 H2O + 3 H2O —– 2Caso4 2H2O
प्लास्टर ऑफ पेरिस (CasO4)2 H2O या CaSO4, 1/2 H2o उपयोग-
1. प्लास्टर ऑफ पेरिस का उपयोग मूर्ति बनाने किया जाता है।
2. इसका उपयोग शल्य चिकित्सा में टूटी हुई हड्डियों व बैठाने व जोड़ने में पट्टियों के रूप में किया जाता है।
जलयोजित लव (hydrated salt)
जिनमें रवाकरण के जल होते हैं वे जलयोजित लव (hydrated salt) कहलाते हैं
अनार्द्र लवण (anhydrous salt)
जिन लवणों में रवाकरण के जल नहीं होते अनार्द्र लवण (anhydrous salt) कहलाते हैं।
Cuso45H20 → Cuso4, + 5H20
तूलिया या कॉपर सल्फेट → अनार्द्र कॉपर सल्फेट (नीला)
Na2CO310H20 → Na2CO3, + 10H2O
धोने का सोडा →अनार्द्र सोडियम कार्बोनट
2Caso42H2O → (Caso4),2H2O + 3H2O
प्रस्वेध लवण(Deliquescent salt) : –
कुछ लवणों में जल के लिए अत्यधिक प्रीति होता है इन लवणों को कुछ देर खुली हवा में छोरने पर ये वायु के जलवाष्प को अवशोषित कर पसीजने लगता है ऐसे लवण को प्रस्वेध लवण कहते है Mgcl2 Cacl2
उत्फुल्लन (Efflorescence) —
Na2CO3·10H2O हवा में खुला छोड़ने पर रवाकरण के जल को त्याग सोडियम कार्बोनेट मोनोहाइड्रेट का चूर्ण बनना उत्फुल्लन कहलाता है।
8 महत्वपूर्ण रासायनिक यौगिक एवं उसके रासायनिक सूत्र ( 8 Best Chemical compound and thier chemical formula –)
रासायनिक यौगिकों की सूची- उनके और उनके रासायनिक सूत्र List of Chemical compounds- their and thier chemical formula
| यौगिक का नाम | यौगिक रासायनिक सूत्र |
| ( बेकिंग सोडा ) खाने का सोडा | NaHco3 |
| धोने का सोडा | Na2Co310पानी / Na2Co310H20 |
| जिप्सम – | Caso4 2पानी |
| प्लास्टर ऑफ़ पेरिस | Caso4 1/2 पानी |
| विरंजक चूर्ण | Caocl2 |
| बुझा चुना | Ca(OH)2 |
| संगमरमर | Caco3 |
| कास्टिक सोडा | NAOH |
विभिन्न पदार्थों में पाया जाने वाला अम्ल (Acid found in different substances)
फलों और सब्जियों में मौजूद अम्लों के नामों की सूची (List names of acids present in fruits and vegetables )
| पदार्थ | उपस्थित अम्ल |
| सेब | मैलिक अम्ल |
| इमली | टार्टरिक अम्ल |
| संतरा व नींबू खट्टा फल | साइट्रिक अम्ल |
| सिरका | ऐसीटिक अम्ल |
| दुध दही | लैक्टिक अम्ल |
| टमाटर | ऑक्जैलिक अम्ल |
| आमाशय-रस | हाइड्रोक्लोरिक अम्ल |
| चाय | टैनिक अम्ल |
| लाल चींटी | फॉर्मिक अम्ल |
| विटामिन C | ऐस्कॉर्बिक अम्ल |
| शुक्र ग्रह | सल्फ्यूरिक अम्ल |
विभिन्न पदार्थों के pH मान की सूची -(List of pH value of different substances )
विभिन्न पदार्थों के pH मान की सूची List of pH value of different substances
| विलयन | PH मान |
| अमाशय –रस | 1.0 |
| नींबू | 2.4 |
| सिरका | 3.0 |
| टमाटर | 4.1 |
| पसीना | 4.5 |
| अम्ल वर्षा | 5.6 |
| पेशाब | 6.0 |
| दुध | 6.4 |
| आंसू | 7.4 |
| खून | 7.4 |
| अम्ल पित | 7.5 – 8.5 |
| चुना जल | 11.0 |
class 10th bharti bhawan अम्ल भस्म लवण का पार्ट -1 देखने के लिए यहा क्लिक करे-







4 thoughts on “class 10th bharti bhawan अम्ल भस्म लवण | bihar board 10th exam 2022”